

|
Experiment des Monats
|
Ascorbinsäure (Vitamin C) ist ein sehr starkes Reduktionsmittel. Es ist in der Lage, Silber-Ionen auch in saurer Lösung zu reduzieren (Glucose kann das nur in alkalischem Milieu). Durch dieses Experiment kann abgeschätzt werden, wie viel Ascorbinsäure in Früchten enthalten ist.
 |
 |
 |
Geräte und Chemikalien:
Reagenzgläser, Reibschale mit Pistill, Trichter, dünne Baumwolltücher
5%ige Essigsäure,
1%ige Silbernitrat-Lösung,
verschiedenes Obst und Gemüse.
Durchführung:
Aus den Pflanzenteilen muß ein Preßsaft gewonnen werden. Zitrusfrüchte lassen sich
einfach auspressen, weiches Obst (Pfirsich, Kiwi) wird zerkleinert und in einem Baumwolltuch
ausgedrückt. Feste Früchte (z.B. Paprika) kann man in einer Reibschale zerdrücken
und dann durch ein Tuch pressen. Grüne Pflanzenteile (z.B. Petersilie, Spinat) werden mit
Quarzsand und Essigsäure verrieben. Jeweils 3 ml des Preßsaftes werden in ein
Reagenzglas gegeben und 1 ml 5%ige Essigsäure zugesetzt (außer bei den Proben,
bei denen schon mit Essigsäure verrieben wurde). Nun werden 10 Tropfen 1%ige
Silbernitrat-Lösung zugegeben, die Proben geschüttelt und ca. eine Stunde an einen
dunklen Ort gestellt (durch Sonnenlicht erfolgt eine photochemische Zersetzung des Silbernitrats).
In dieser Zeit stellt sich eine unterschiedlich starke Schwärzung in den Proben ein -
abhängig vom Ascorbinsäure-Gehalt in der Probe.
Im vorliegenden Experiment wurden verwendet (von links nach rechts; in Klammer: Gehalt an
Ascorbinsäure in 100 g Nahrungsmittel):
(1) Petersilie (150-180 mg)
(2) Kiwi (80-120 mg)
(3) Zitrone (50-60 mg)
(4) Paprika, gelb (100-150 mg)
(5) Pfirsich (ca. 10 mg)
(6) Tomate (20-30 mg)
Die intensivste Schwarzfärbung zeigte sich bei der Paprika, gefolgt von Kiwi, Zitronensaft,
Tomate und Petersilie. Beim Pfirsichsaft ist fast keine zu erkennen. Die Abfolge entspricht also
relativ gut dem durchschnittlichen Vitamin C Gehalt, nur bei der Petersilie war die Extraktion
offenbar unvollständig (oder es war ungewöhnlich wenig enthalten). Durch die Eigenfarbe
der Früchte und unterschiedlicher Trübung ist der Abgleich nicht immer eindeutig, es ist
aber eine deutliche Tendenz erkennbar.
 |
Erklärung:
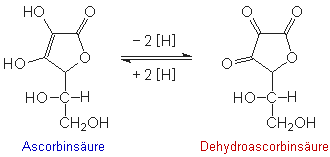
Ascorbinsäure wird leicht zu Dehydroascorbinsäure oxidiert.
( EdM 02/2004 &
EdM 08/2007)
Silber(I)-Ionen sind vor allem in basischer Lösung ein starkes Oxidationsmittel
(
EdM 02/2004 &
EdM 08/2007)
Silber(I)-Ionen sind vor allem in basischer Lösung ein starkes Oxidationsmittel
( EdM 12/1999),
in saurer Lösung werden sie jedoch nur durch sehr starke Reduktionsmittel zu elementarem
Silber reduziert. Das Silber fällt feinverteilt aus und erscheint daher schwarz.
EdM 12/1999),
in saurer Lösung werden sie jedoch nur durch sehr starke Reduktionsmittel zu elementarem
Silber reduziert. Das Silber fällt feinverteilt aus und erscheint daher schwarz.
Gefahren:

Silbernitrat ist ätzend und umweltgefährdend, konzentrierte Essigsäure ist
ätzend (5%ige entspricht jedoch dem Haushaltsessig).
Entsorgung:
Die Lösungen kommen zum Schwermetallabfall.
Literatur & Links:
F. Bukatsch, W. Glöckner: Experimentelle Schulchemie, Bd. 9, V. 84, S. 123-125
H. K. Biesalski; P. Grimm: "Taschenatlas der Ernährung"
G. Schwedt: "Noch mehr Experimente mit Supermarktprodukten", Exp. 169, S. 220
E. Nitsche, A. Schunk: Chemie der Nahrungsbestandteile (Lehrerfortbildungen am LFBZ Frankfurt/Main, 2007-12)
Juni 2012: Erhitzen mit Mikrowellen
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Samstag, 7. Juli 2012,
A. Schunk,
Charité - Universitätsmedizin Berlin.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!