

|
Experiment des Monats
|
Der Gehalt an Ascorbinsäure (Vitamin C) kann leicht durch eine Redox-Titration bestimmt werden. Hier wird die Methode der Rücktitration angewandt. Das Verfahren kann auch bei Lebensmitteln angewandt werden. Viele Getränke enthalten Ascorbinsäure - meist zugesetzt als Vitamin-Dosis oder als Antioxidationsmittel. Mit diesem Experiment kann in solchen Getränken (Fruchtsäfte, Erfrischungsgetränke, Energy-Drinks usw.) der Ascorbinsäure-Gehalt bestimmt werden, sofern sie keine zu starke Eigenfarbe habe (da sonst der Umschlagspunkt nicht mehr gut genug erkennbar ist).
 |
Geräte und Chemikalien:
250 ml Erlenmeyerkolben mit Stopfen, Bürette, 100 ml Meßzylinder,
20 ml Vollpipette, 2 ml Meßpipette, kleiner Glastrichter, Becherglas;
0,05 M Jod-Kaliumjodid-Lösung,
0,1 M Natriumthiosulfat-Lösung,
1 M Schwefelsäure,
1%ige Stärke-Lösung.
Durchführung:
100 ml der zu untersuchenden Lösung in den Erlenmeyerkolben geben und
mit 2 ml verd. Schwefelsäure ansäuern.
20 ml Jodlösung zugeben, den Kolben verschließen und vorsichtig
schütteln. Das Gemisch 15 Minuten bei Raumtemperatur reagieren lassen.
1 ml Stärke-Lösung als Indikator zugeben und mit 0,1 M
Thiosulfat-Lösung bis zur Entfärbung der blauen Jodstärke tritrieren.
 |
Erklärung:
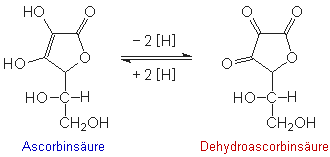
Ascorbinsäure kann leicht oxidiert werden
(vgl. EdM 02/2004).
Bei diesem Experiment wird die Ascorbinsäure durch Jod oxidiert, das
im Überschuß zugegeben wird:
C6H8O6 + I2
 C6H6O6 + 2 HI
C6H6O6 + 2 HI
Das überschüssige Jod wird anschließend bei der Titration mit Thiosulfat reduziert:
I2 + 2 Na2S2O3
 2 NaI + Na2S4O6
2 NaI + Na2S4O6
Bei der Reaktion werden ggf. auch andere, sehr leicht reduzierbare Bestandteile der Getränke mit erfaßt, jedoch keine Zucker (Glucose, Fructose usw.).
Auswertung:
Zur Lösung wurden 20 ml 0,05 M Jodlösung gegeben, also
1 mmol I2. Da 2 mmol Thiosulfat 1 mmol Jod reduzieren,
die Thiosulfat-Lösung aber die doppelte Konzentration besitzt, würden
zur Umsetzung der gesamten Jod-Menge 20 ml der Thiosulfat-Lösung
benötigt. Die Differenz zwischen dem tatsächlichen Verbrauch und
dem theoretischen Wert entspricht der Ascorbinsäure-Menge in der Probe.
Beispiel:
Verbrauch: 16 ml 0,1 M Thiosulfat-Lösung = 1,6 mmol S2O32–
=> 0,8 mmol I2 waren noch in der Lösung, d.h. 0,2 mmol I2 wurden durch die Ascorbinsäure reduziert.
In 100 ml Getränk sind 0,2 mmol Ascorbinsäure = 35,2 mg (M = 176 g/mol) enthalten.
Gefahren:
Schwefelsäure ist ätzend.
Entsorgung:
Die Lösungen können zum Abwasser gegeben werden.
Literatur & Links:
Praktikum Chemie für Mediziner, Universität Erlangen-Nürnberg
Edith Nitsche: Seminar "Lebensmittelchemie" (Universität Koblenz-Landau)
Edith Nitsche & Axel Schunk: "Ernährung - Chemie der Nahrungsbestandteile"
(Lehrerfortbildung am LFBZ Frankfurt/Main, 2007)
Rüdiger Blume:
Maßanalytische Redoxtitrationen der Ascorbinsäure
Chemie für Mediziner: Ascorbinsäure
Frau Dr. Edith Nitsche und den Lehramt-Studierenden Heike Salmen und Thomas Baingo, Institut für Didaktik der Chemie, J.W.Goethe-Universität Frankfurt am Main, danke ich sehr herzlich für die Unterstützung.
Juli 2007: Konzentrationszellen
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Dienstag, 31. Juli 2007, A. Schunk, Institut für Didaktik der Chemie, Johann Wolfgang Goethe Universität Frankfurt am Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!