

|
Experiment des Monats
|
Ascorbinsäure (Vitamin C) ist für den Menschen essentiell. Sie ist ein wichtiges Reduktionsmittel und als solches beispielsweise an der Collagen-Synthese beteiligt. Das Vitamin kommt vor allem in Obst und Gemüse vor. Besonders hoch ist der Gehalt in Hagebutten (bis 1,3%), Sanddorn (bis 0,5%) und schwarze Johannisbeeren (bis 0,2%), aber auch Zitrusfrüchte, Kiwi, Paprika und die meisten Kohl-Sorten enthalten viel Vitamin C. Hier spielt die Zubereitung der Lebensmittel eine große Rolle, denn Ascorbinsäure ist hitze- und oxidationsempfindlich. Starkes Erhitzen an der Luft führt in kurzer Zeit zum Vitaminverlust.
 |
 |
Geräte und Chemikalien:
0,1%ige Ascorbinsäure-Lösung,
1%ige Kaliumpermanganat-Lösung,
verdünnte Schwefelsäure
Erlenmeyerkolben, Bechergläser.
Durchführung:
In zwei Erlenmeyerkolben jeweils 100 ml Wasser mit
2 ml 1%ige KMnO4-Lösung versetzen
und mit etwas verdünnter Schwefelsäure ansäuern.
Zum ersten Kolben 50 ml 0,1%ige Ascorbinsäure-Lösung
(frisch bereitet) geben. Die violette Lösung entfärbt
sich sofort. 50 ml der Ascorbinsäure-Lösung
werden mindestens 10 Minuten gekocht. Wird diese Lösung
zum zweiten Kolben gegeben, bleibt die violette Färbung
weitgehend erhalten, es entsteht nur etwas Braunstein.
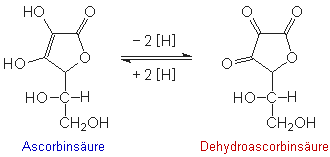 |
Erklärung:
Ascorbinsäure ist ein starkes Reduktionsmittel.
Schwache Oxidationsmittel überführen sie in
Dehydroascorbinsäure. Diese Reaktion ist reversibel.
Permanganat-Ionen werden von Ascorbinsäure zu Mn2+
reduziert.
Das Vitamin reagiert auch mit Luftsauerstoff,
besonders bei höheren Temperaturen.
Dabei wird die Dehydroascorbinsäure weiter (irreversibel)
oxidiert. Die Oxidationsprodukte können Permanganate
nicht mehr reduzieren.
Gefahren:


Kaliumpermanganat ist brandfördernd und gesundheitsschädlich,
Schwefelsäure ist ätzend.
Entsorgung:
Die Lösungen kommen zum Schwermetall-Abfall.
Literatur & Links:
Quarks & Co.: ABC der Vitamine (WDR 3, 04.11.2003)
Chemie für Mediziner: Vitamin C
eigene Unterlagen
Januar 2004: Bunte Eisen-Komplexe
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Freitag, 30. Januar 2004, A. Schunk, CCC Univ. Erlangen.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!