

|
Experiment des Monats
|
Stärke und Zellulose sind Polymere, die aus Glucose-Molekülen aufgebaut sind. Beide Makromoleküle können hydrolysiert werden, jedoch unterscheiden sich die Reaktionsbedingungen dabei erheblich.
 |
 |
 |
Geräte und Chemikalien:
2 Bechergläser, 2 Reagenzgläser, Wasserbad, Heizplatte, Glastrichter, Rundfilter;
Stärke (Mehl, Speisestärke, etc.),
Papier (oder Zellulose-Fasern, z.B. Baumwollstoff, Watte)
10%ige Salzsäure,
konz. Schwefelsäure,
Natriumcarbonat;
FEHLING-Reagenz:
Kupfersulfat,
Natriumhydroxid,
Kaliumnatriumtartrat.
Durchführung:
(1) Einen Spatel voll Stärke in 100 ml Wasser geben und aufkochen, bis eine
klare Lösung entstanden ist. In die heiße Lösung 10 Tropfen
10%ige Salzsäure geben und 5 min. kochen. Mit Natriumcarbonat die
saure Lösung neutralisieren. Mit dem Hydrolysat die
FEHLING-Probe durchführen.
(2) Ein Stück Filterpapier (oder andere Zellulose-Fasern) mit 5 ml
konz. Schwefelsäure versetzen und zu einem Brei verrühren.
Vorsichtig (!) 40 ml Wasser zugeben und 30 min. kochen.
Die Lösung filtrieren, mit Natronlauge oder Natriumcarbonat neutralisieren
und die FEHLING-Probe durchführen.
Beim zweiten Versuch (Zellulose-Spaltung) erfolgt der Fehling-Nachweis meist nicht
so eindrucksvoll wie sonst bei Zuckern, ist aber dennoch als positiv erkennbar.
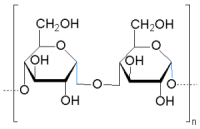 Amylose |
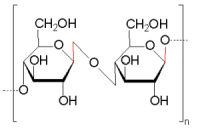 Cellulose |
Erklärung:
Amylose (Stärke) und Cellulose bestehen jeweils aus Glucose-Einheiten.
Sie unterscheiden sich nur in der Art, wie diese Moleküle verknüpft sind.
Bei der Amylose liegt eine α-glycosidische Bindung vor, die relativ leicht
hydrolytisch gespalten werden kann. Um eine positive Fehling-Reaktion auszulösen,
reichen schon kurzkettige Bruchstücke aus.
Die Stärke-Hydrolyse läuft auch im Organismus bei der Verdauung
(katalysiert durch Enzyme) ab.
Die β-glycosidischen Bindungen der Cellulose sind stabiler. Sie werden nur durch
konzentrierte Säuren - bzw. in der Natur von bestimmten Bakterien oder Pilzen
gespalten. Die Hydrolyse von Cellulose durch konzentrierte Säuren wird
beispielsweise bei der "Holzverzuckerung" angewandt.
Gefahren:

Salzsäure, Schwefelsäure und Natronlauge sind ätzend,
Kupfersulfat ist gesundheitsschädlich.
Entsorgung:
Die Lösungen werden zum Schwermetallabfall gegeben.
Literatur & Links:
Peter Grob: Einfache Schulversuche zur Lebensmittelchemie,
Experiment 2.13 - S. 62-64
F. Bukatsch, W. Glöckner: "Experimentelle
Schulchemie", Bd. 8 - Versuch 116, S. 135-140 & Versuch 125, S. 159-162
J. Gasteiger, A. Hofmann, A. Schunk:
Chemie für Mediziner: Glykoside
Edith Nitsche: persönliche Mitteilung
Frau Dr. Edith Nitsche, Institut für Didaktik der Chemie, J.W.Goethe-Universität Frankfurt am Main, danke ich sehr herzlich für die Unterstützung.
Oktober 2007: Pyrolyse von Eiweiß
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Mittwoch, 31. Oktober 2007, A. Schunk, Institut für Didaktik der Chemie, Johann Wolfgang Goethe Universität Frankfurt am Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!