

|
Experiment des Monats
|
In diesem Experiment wird die elementare Zusammensetzung von Eiweiß untersucht. Der Versuch funktioniert am besten mit getrocknetem Hühnereiweiß, kann prinzipiell aber auch mit anderen Proteinen durchgeführt werden.
 |
 |
 |
Geräte und Chemikalien:
hochschmelzendes Reagenzglas, Bunsenbrenner, Stativ, Pinzette, Glasstab;
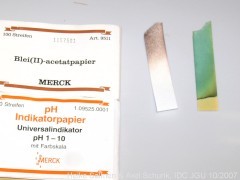
Bleiacetat-Papier,
Kobaltchlorid-Papier,
Universalindikator-Papier,
Kalkwasser.
Durchführung:
Das Experiment in einem Abzug durchführen, da giftige Dämpfe entstehen!
Das Reagenzglas etwa 1 cm hoch mit getrocknetem Hühnereiweiß
füllen und waagerecht einspannen. Mit dem Bunsenbrenner zunächst leicht
mit kleiner Flamme erwärmen, bis sich Flüssigkeitstropfen bilden.
Kobaltchlorid-Papier mit der Flüssigkeit benetzen.
Nun kräftig erhitzen, bis ein dichter Nebel entsteht. Den Nebel mit
feuchtem Indikatorpapier und Bleiacetatpapier untersuchen. Einen Tropfen
Kalkwasser mit dem Glasstab an den Nebel halten.
Kobaltchlorid-Papier kann hergestellt werden, indem Filterpapier in eine konzentrierte CoCl2-Lösung getaucht und anschließend im Trockenschrank getrocknet wird, bis es blau ist. Für Schülerversuche dürfen keine Kobalt-Verbindungen verwendet werden. Als Alternative kann dann Kupfersulfat-Papier (trocken ist es weiß, feucht blau) eingesetzt werden.
Erklärung:
Eiweiße (Proteine) bestehen aus verschiedenen Aminosäuren, die
alle Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff enthalten. Methionin
und Cystein besitzen ausserdem ein Schwefel-Atom. Bei der Pyrolyse (also der
vollständigen Zersetzung bei hohen Temperaturen) entstehen aus den
organischen Molekülen CO2, H2O, NH3,
H2S und Reste an Kohlenstoff.
Wasser kann durch das Kobaltchlorid-Papier nachgewiesen werden: wasserfreies
CoCl2 nimmt dabei 6 H2O auf und es entsteht der rote
[Co(H2O)6]2+-Komplex.
In Kalkwasser bildet sich mit CO2 ein Niederschlag aus CaCO3,
der Tropfen trübt sich.
NH3 führt auf dem Universalindikatorpapier zu einer basischen
Reaktion mit Blaufärbung.
Das farblose Bleiacetat wird durch H2S zu schwarzem Bleisulfid (PbS)
umgewandelt.
Überschüssiger Kohlenstoff führt zur Schwarzfärbung der
erhitzten Probe.
Gefahren:


Kalkwasser ist ätzend; Bleiacetat ist giftig.
Bei der Reaktion entstehen giftiger Schwefelwasserstoff und reizender Ammoniak.
Das Experiment muß in einem Abzug durchgeführt werden.
Entsorgung:
Die Rückstände können zum Hausmüll gegeben werden,
das Bleiacetat-Papier kommt zum Schwermetallabfall.
Literatur & Links:
Peter Gross: Einfache Schulversuche zur Lebensmittelchemie,
Experiment 3,6 - S. 77-78
Edith Nitsche: persönliche Mitteilung
Chemie für Mediziner: Aminosäuren & Proteine
Frau Dr. Edith Nitsche und Frau Heike Salmen, Institut für Didaktik der Chemie, J.W.Goethe-Universität Frankfurt am Main, danke ich sehr herzlich für die Unterstützung.
September 2007: Alkohol-Nachweis
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Sonntag, 30. September 2007, A. Schunk, Institut für Didaktik der Chemie, Johann Wolfgang Goethe Universität Frankfurt am Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!