
Experiment des Monats
Januar 2003
Wenn Salze sauer sind ...

5 Jahre Experiment des Monats
& Jahr der Chemie:
Gewinnspiel

|
Experiment des Monats
|
 5 Jahre Experiment des Monats |
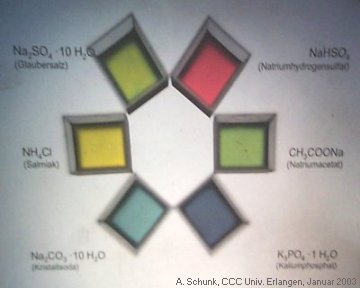
... dann färben sie Indikatoren. Mit diesem Projektionsversuch kann gezeigt werden, welche Salze in wässriger Lösung sauer oder basisch reagieren.
 |
Geräte und Chemikalien: Durchführung:
|
Erklärung:
Wird eine schwache Säure mit einer Lauge neutralisiert,
entsteht ein basisch reagierendes Salz; das Säureanion
kann Protonen aufnehmen. Essigsäure und Kohlensäure
sind schwache Säuren, daher reagieren Acetate und Carbonate
basisch. Phosphorsäure kann drei Protonen abgeben, wobei
der zweite und dritte Dissoziationsschritt schwachen Säuren
entspricht. Auch Hydrogenphosphate und Phosphate reagieren
alkalisch.
Schwefelsäure ist eine zweiprotonige Säure.
Auch Hydrogensulfat ist noch eine starke Säure.
Ammoniumchlorid ist ein Salz der schwachen Base Ammoniak.
Ammoniumsalze reagieren schwach sauer.
Natriumsulfat ist dagegen ein Salz einer starken Säure
(Schwefelsäure) und einer starken Base (NaOH).
Das Salz reagiert neutral.
HSO4– + H2O ® SO42– + H3O+
NH4+ + H2O ® NH3 + H3O+
CH3COO– + H2O ® CH3COOH + OH–
CO32– + H2O ® HCO3– + OH–
PO43– + H2O ® HPO42– + OH–
Säure-Base-Indikatoren sind selbst schwache Säuren oder Basen (vgl. Experiment 11/2000). Universalindikator ist ein Gemisch mehrerer Indikatoren. Hierdurch können durch kontinuierliche Farbänderungen pH-Werte im Bereich 1-13 angezeigt werden.
Hinweis:
Als Praktikumsversuch können die Salze auch auf
feuchtes Universalindikatorpapier auf einem Uhrglas gegeben werden
Gefahren:

Die untersuchten Salze reizen Haut und Augen.
Entsorgung:
Die Lösungen können zum Abwasser gegeben werden.
Literatur & Links:
Praktikum Chemie für Mediziner:
Versuch 4.1
eigene Unterlagen
Frau Dipl.-Chem. Gisela Martinek danke ich sehr herzlich für die Unterstützung.
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Montag, 30. Dezember 2002, A. Schunk, CCC Univ. Erlangen.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!