

|
Experiment des Monats
|
Chemische Gleichgewichte sind temperaturabhängig. Das gilt auch für Dissoziationsgleichgewichte, insbesondere dem von Ammoniak. Durch Farbindikatoren mit Umschlagbereichen um pH 7 lässt sich diese Reaktion sichtbar machen. Das Experiment ist auch als Projektionsversuch geeignet.
 |
 |
 |
Geräte und Chemikalien:
2 Erlenmeyerkolben oder Bechergläser, Heizplatte
5%ige Ammoniak-Lösung,
1%ige Phenolphthalein-Lösung
Durchführung:
Zu 50 ml Wasser 10 Tropfen Phenolphthalein-Lösung geben. Nun so lange
Ammoniak-Lösung zutropfen, bis eine deutliche rosa-Färbung sichtbar ist.
Die Lösung auf zwei Erlenmeyer-Kolben (bzw. Bechergläser) verteilen.
Eine Lösung erhitzen (Abb. 1; nicht bis zum sieden, denn dann würde zu viel NH3
entweichen). Dabei entfärbt sich die Lösung fast vollständig (Abb. 2).
Beim Abkühlen (lässt sich durch ein kaltes Wasserbad beschleunigen) kehrt die
rosa Färbung zurück (Abb. 3).
Erklärung:
Chemische Gleichgewichte sind temperaturabhängig: ΔG = ΔG°+RT·lnK
das gilt auch für die Dissoziation von Ammoniak:
NH3 + H2O 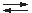 NH4+ + OH–
NH4+ + OH–
Bei steigender Temperatur verschiebt sich das Gleichgewicht in Richtung Ammoniak, d.h. der pH-Wert sinkt.
Beim Abkühlen stellt sich die Ausgangslage wieder ein, der pH-Wert steigt und der Indikator verfärbt sich.
Gefahren:

Ammoniak wirkt reizend.
Entsorgung:
Die Lösungen können - nach Neutralisation z.B. mit Salzsäure - zum Abwasser gegeben werden.
Literatur & Links:
Leonard A. Ford: "Chemical Magic", S. 5
Juli 2012: Molisch-Giroud-Reaktion
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Mittwoch, 1. August 2012,
A. Schunk,
Charité - Universitätsmedizin Berlin.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!