

|
Experiment des Monats
|
Kristallviolett entfärbt sich in alkalischer Lösung. Diese Reaktion läßt sich sehr gut in einem Spektralphotometer beobachten und ist für reaktionskinetische Untersuchungen geeignet.
 |
Geräte und Chemikalien:
Spektralphotometer, Küvette, Stoppuhr, Pipetten.
50 µmol/l Kristallviolett-Lösung,
0,1 mol/l Natronlauge.
 |
Durchführung:
Zuerst muß das Photometer (gem. Anleitung) kalibriert werden. Die Messungen erfolgen bei 560 nm.
5 ml der Kristallviolett-Lösung mit 5 ml Wasser verdünnen und den Startwert bestimmen.
Als Reaktionsansatz 5 ml Kristallviolett-Lösung mit 5 ml Natronlauge mischen und Stoppuhr starten.
Die Küvette füllen und alle 15 Sekunden die Extinktion ablesen.
Über das Lambert-Beersche-Gesetz werden die Konzentrationen berechnet:
E = ε · c · d
E: Extinktion, ε: Extinktionskoeffizient, c: Konzentration, d: Schichtdicke
ε = 20.000 l/mol·cm
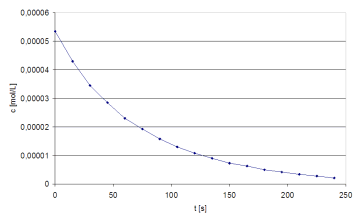
Das c/t-Diagramm zeigt den typischen Verlauf einer Reaktion 1. Ordnung. Wird log c gegen die Zeit
aufgetragen, ergibt sich eine Gerade. Aus deren Steigung kann die Geschwindigkeitskonstante berechnet werden.
Erklärung:
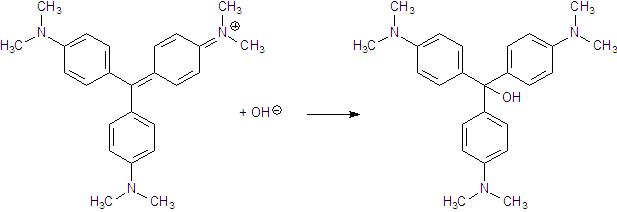
In alkalischer Lösung lagert sich ein Hydroxid-Ion an den violetten Triphenylmethanfarbstoff an.
Dadurch wird das konjugierte π-System unterbrochen, der Absorptionsbereich liegt nicht mehr im sichtbaren Bereich,
die Lösung wird farblos. Da die Hydroxid-Ionen in starkem Überschuß zugegeben wurden, ändert
sich deren Konzentration kaum. Die Reaktionsgeschwindigkeit hängt nur von der Kristallviolett-Konzentration ab
und die Reaktion verläuft somit nach einem Geschwindigkeitsgesetz 1. Ordnung.
Gefahren:
Natronlauge ist ätzend; Kristallviolett wirkt möglicherweise cancerogen.
Entsorgung:
Die neutralisierten Lösungen können zum Abwasser gegeben werden.
Literatur & Links:
W. Glöckner, W. Jansen, R. G. Weißenhorn (Hrsg.):
Handbuch der Experimentellen Chemie, Sekundarbereich II - Band 8. Köln: Aulis-Deubner, 2004
J. Salzner, A. Schunk: Lehrerfortbildung Reaktionskinetik, LFBZ Frankfurt/Main, 2007-09
Herrn Dr. Jens Salzner, Institut für Didaktik der Chemie, Goethe-Universität Frankfurt am Main, danke ich sehr herzlich für die Unterstützung.
Juni 2009: pH-Werte von Aminosäuren
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Dienstag, 30. Juni 2009,
A. Schunk,
Charité - Universitätsmedizin Berlin.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!