 |
|
"Kaltes Licht" fasziniert nicht nur die Chemiker bereits seit Jahrhunderten.
Es entsteht bei chemischen Reaktionen, bei der die Energie nicht als Wärme,
sondern in Form von sichtbarem Licht ausgesendet wird.
Der als Chemilumineszenz (Chemolumineszenz) bezeichnete Effekt wurde zuerst bei
weißem Phosphor beobachtet. Phorphor wird durch Luftsauerstoff langsam
oxidiert, wobei fahlgrünes Licht ausgesendet wird. Phophor ist jedoch
sehr giftig. Die Chemilumineszenz des Luminols läßt sich dagegen
ohne größere Gefährdung vorführen.
Geräte und Chemikalien:
Luminol,
Natronlauge,
Kaliumhexacyanoferrat(III) oder
Hämin,
Wasserstoffperoxid,
Fluorescein,
Rhodamin B
Rundkolben oder Erlenmeyerkolben, Bechergläser, ggf. Schlangenkühler, Trichter.
Durchführung:
Zunächst werden zwei Lösungen hergestellt:
Lösung A: 1 g Luminol werden in 450 ml Wasser + 50 ml
10%ige Natronlauge gelöst.
Lösung B: 3%ige Lösung von Kaliumhexacyanoferrat(III) = rotes Blutlaugensalz
[alternativ: eine Spatelspitze Hämin in 15 ml verd. Ammoniaklösung
lösen und in 100 ml Wasser geben]
Der Raum sollte nun abgedunkelt werden.
Je 50 ml der Lösungen A und B in 700 ml Wasser werden gegeben und
3 ml 30%ige Wasserstoffperoxid-Lösung zusetzen. Es beginnt sofort
eine intensive blaue Lumineszenz.
Besonders effektvoll wird der Versuch, wenn diese blau leuchtende Lösung durch
einen Schlangenkühler in einen zweiten Kolben gegossen wird.
Befindet sich im Auffanggefäß ein Fluoreszenzfarbstoff, leuchtet dieser
in einer anderen Farbe. Besonders geeignet sind Fluorescein (gelbgrün) und
Rhodamin B (rotviolett).
|
|
Erklärung:
Luminol (3-Aminophthalsäure-hydrazid) wird durch Wasserstoffperoxid oxidiert,
wobei bestimmte Metallionen (z.B. Fe(III) im Hexacyanoferrat) als Katalysator wirken.
Als Zwischenstufe tritt ein cyclisches Peroxid auf, bei dessen Zerfall Licht
emittiert wird. Die Lösung erwärmt sich nur geringfügig; die
freiwerdende Energie wird überwiegend in Form von Licht abgegeben.
Die Energie kann von Luminol auf Fluoresfarbstoffe übertragen werden;
dadurch kann Licht anderer Wellenlänge (und damit Farbe) entstehen.
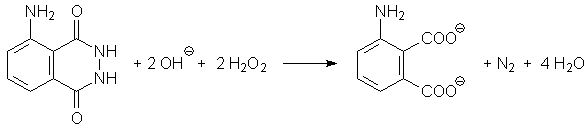
Bei der Oxidation des Luminols entsteht zunächst ein cyclisches Peroxid.
Aus diesem wird N2 abgespalten, wobei ein elektronisch angeregtes
Zwischenprodukt entsteht. Beim Übergang in den Grundzustand wird Energie
in Form von Licht ausgesendet. Die dabei freiwerdende Energie kann auch auf andere
aromatische Moleküle übertragen werden. Handelt es sich dabei um
Fluoreszenzfarbstoffe, werden diese angeregt und es wird Licht mit der für
die Farbstoffe charakteristischen Wellenlänge emittiert.
Ohne Katalysator ist die Reaktion relativ langsam, es erscheint nur eine schwache
Lumineszenz. Komplexierte Eisen(III)-Ionen wirken als effektive
Katalysatoren, die zu einer deutlichen Verstärkung der Leuchterscheinung
führen. Geeignet ist u.a. Hexacyanoferrat(III). Häm-Komplexe sind aber
wesentlich aktiver. Hämin ist ein Porphyrin-Eisen-Komplex, wie er beispielsweise
auch im Hämoglobin, dem roten Blutfarbstoff, enthalten ist. Die Katalyse
durch Häm-Komplexe ist so empfindlich, daß diese Chemolumineszenz
auch zum Aufspüren kleiner Blutmengen eingesetzt wird.
Gefahren:

Wasserstoffperoxid und Natronlauge sind stark ätzend,
Kaliumhexacyanoferrat(III) ist gesundheitsschädlich.
Entsorgung:
Die Loesungen kommen zum anorganischen (wässrigen) Abfall.
Literatur & Links:
F. Bukatsch, O. Krätz, G. Probeck, R. Schwankner: "So interessant
ist Chemie" - Versuch 105, S. 109-111
F. R. Kreißl, O. Krätz: "Feuer und Flamme,
Schall und Rauch" - Versuch 15.1+15.2, S. 136-138
H. W. Roesky, K. Möckel: "Chemische
Kabinettstücke" - Versuch 65, S. 160-162
G. Wagner: "Chemie in faszinierenden Experimenten"
- V. 74, S. 87-91
Dr. Robert Opferkuch, Universität Ulm, persönliche Mitteilung
Den Herren Harald Donath, Fritjof Schmock und Henning Thuleweit,
Philipps-Universität Marburg,
danke ich sehr herzlich für die Unterstützung und die Hinweise,
Herrn Michael Marsch herzlichen Dank für das Foto
( weitere Fotos).
weitere Fotos).
Dezember 2005: Grüne Flammen
|


 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment