
Experiment des Monats
Oktober 2003
Kupfer/Zink-Lokalelement


|
Experiment des Monats
|

|
Sind zwei Metalle leitend miteinander verbunden, liegt ein Lokalelement vor. An Lokalelementen laufen elektrochemische Reaktionen besonders schnell ab. Lokalelemente spielen daher eine große Rolle in der Technik, aber auch in der Medizin.
 |
 |
 |
Geräte und Chemikalien:
2 M Kupfersulfat-Lösung,
Zinkblech,
2 M Salzsäure
Becherglas, Reagenzglas, Stativ.
Durchführung:
Ein Zinkblech wird zur Hälfte in eine Kupfersulfatlösung getaucht.
Dabei überzieht sich das Blech mit einer braun-schwarzen Kupferschicht.
Das Blech mit dem Kupferüberzug nach oben in ein mit verdünnter
Salzsäure (oder verdünnter Schwefelsäure) gefülltes
Reagenzglas geben. Sofort beginnt eine intensive Gasentwicklung,
die an der Grenze zwischen blankem Zinkblech und Kupferüberzug
am stärksten ist. In der Abbildung ist auch an der Ecke rechts
oben, dem Ansatzpunkt der Pinzette, eine starke Blasenbildung erkennbar.
 |
Erklärung:
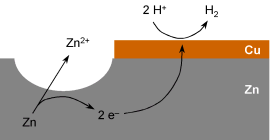
Zink ist ein unedles Metall, es wird daher von verdünnten Säuren
angegriffen. Durch den Kupferüberzug liegt ein Lokalelement vor.
An einem Lokalelement laufen Oxidation und Reduktion räumlich
getrennt ab. Die Oxidation erfolgt bei dieser Reaktion an der freien
Zinkoberfläche:
 Zn2+ + 2 e–
Zn2+ + 2 e–
 H2
H2
Hinweise:
Lokalelemente können auch zum Korrosionsschutz ausgenutzt werden.
In der Mundhöhle können beim gleichzeitigen Einbringen von
Amalgam- und Gold-Füllungen Lokalelemente ausgebildet werden.
 Chemie für Ärzte
Chemie für Ärzte
Gefahren:

Kupfersalze sind gesundheitsschädlich.
Entsorgung:
Die neutralisierten Lösungen kommen zum Schwermetall-Abfall.
Literatur & Links:
Praktikum Chemie für Mediziner:
Versuch 5.4
eigene Unterlagen
Frau Dipl.-Chem. Gisela Martinek, Herrn Dipl.-Umw.Wiss. Simon Spycher und Herrn cand. med. Tobias Vogt danke ich sehr herzlich für die Unterstützung.
September 2003: Reaktionsträgheit der Alkane
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Dienstag, 30. September 2003, A. Schunk, CCC Univ. Erlangen.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!