
Experiment des Monats
Juni 2003
Permanganat-Fontaine


|
Experiment des Monats
|

|
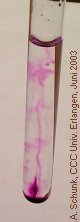
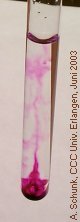
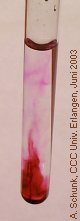
In einer farblosen Oxalsäure-Lösung entsteht eine durch Gasblasen angetriebene violette Fontaine. Besonders wirkungsvoll ist dieser Versuch in einer Küvette, die projiziert wird.



Geräte und Chemikalien:
Kaliumpermanganat,
verd. Schwefelsäure,
Oxalsäure
oder Kaliumoxalat,
Reagenzgläser, Spatel.
Durchführung:
In einem Reagenzglas eine 5%ige Oxalsäure-Lösung mit
etwas H2SO4 ansäuern.
Nun einen kleinen KMnO4-Kristall in die
Lösung geben. Beim Absinken entsteht eine violette
Spur, die bald verschwindet. Am Boden beginnt eine
Gasentwicklung, beim Aufsteigen der Gasblasen werden
kleine Mengen der Permanganat-Lösung mitgerissen.
Bei zunehmender Intensität der Reaktion entsteht
so der Eindruck einer violetten Fontaine.
Bei fortschreitender Reaktion entstehen oft auch
gelbbraune Manganate(IV).
Erklärung:
Permanganat-Ionen werden in saurer Lösung durch
Oxalate zu fast farblosen Mn2+-Ionen reduziert,
die Oxalate dabei zu gasförmigem CO2 oxidiert.
Die Reaktion wird durch die entstehenden Mn2+-Ionen
katalysiert, daher nimmt die Reaktionsgeschwindigkeit zu.
2 KMnO4 + 5 H2C2O4 + 3 H2SO4
 2 MnSO4 + 10 CO2 + K2SO4 + 8 H2O
2 MnSO4 + 10 CO2 + K2SO4 + 8 H2O
Gefahren:



Kaliumpermanganat ist brandfördernd, gesundheitsschädlich
und ätzend, Schwefelsäure ist ätzend,
Oxalsäure gesundheitsschädlich.
Entsorgung:
Die Lösung kommt zum Schwermetall-Abfall.
Literatur & Links:
Ekkehard Diemann: "Permanganat-Fontaine";
PdN-Chemie, 49 (2000), 35
S. Nick, I. Parchmann, R. Demuth: "Chemisches Feuerwerk" - V. 20, S. 105-107
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Freitag, 30. Mai 2003, A. Schunk, CCC Univ. Erlangen.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!