

|
Experiment des Monats
|
Der Name "Zeolithe" wurde 1756 von dem schwedischen Mineralogen
AXEL F. CRONSTEDT eingeführt.
Er erkannte auch, daß es sich bei diesen Mineralien um eine
eigene Gruppe handelt. Die Zeolithe sind Gerüstsilikate, enthalten
also Silizium- und Aluminium-Zentren, sowie verschiedene andere Metallionen.
Inzwischen sind über 150 Zeolithe bekannt, etwa 30 kommen in der Natur vor.
Die technisch verwendeten Zeolithe werden jedoch in der Regel synthetisiert.
Zeolithe kommen als Trockenmittel ("Molekularsieb"), Ionenaustauscher
(z.B. zur Wasserenthärtung) oder als Katalysatoren zum Einsatz.
Die hier vorgestellten Experimente ermöglichen Rückschlüsse
auf den Aufbau der Zeolithe.
Herrn Dr. Bernd Lutz, Didaktik
der Chemie der Universität Würzburg,
danke ich sehr herzlich für die Hinweise und die Unterstützung.
|
Versuch 1: Geräte und Chemikalien: Durchführung: |
 |
|
Versuch 2: Geräte und Chemikalien: Durchführung: |
 |
Erklärung:
Die meisten Zeolithe können als Ionenaustauscher fungieren. Sie enthalten
Alkali- oder Erdalkalimetall-Ionen, die sie an die Lösung abgeben und statt
dessen andere Ionen, z.B. Ca2+, binden können. Auf dieser Eigenschaft
beruht ihr Einsatz als Wasserenthärter in Waschmitteln. Statt Metallionen
können auch Protonen aus der Lösung gebunden werden. Zeolithe reagieren
deshalb als Basen, zugesetzte Indikatoren zeigen alkalische Reaktion.
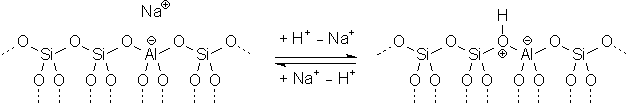
Auch organische Kationen können an das Zeolith-Gerüst gebunden werden. Deshalb können Zeolithe durch kationische Farbstoffe, z.B. Methylenblau, angefärbt werden. Anionische Moleküle werden dagegen vom negativ geladenen Silikat-Gerüst abgestoßen und können wieder ausgewaschen werden.
Im Schulunterricht können diese Experimente zur "Strukturaufklärung" herangezogen werden. Der erste Versuch zeigt, daß die Zeolithe in Wasser dissoziieren. Mit Versuch 2 wird nachgewiesen, daß das Grundgerüst negativ geladen ist. Wird zusätzlich ein Silikat- und Aluminiumnachweis durchgeführt, können die Zeolithe als Alumosilikate gedeutet werden, die austauschfähige Alkali- oder Erdalkalimetalle enthalten.
Entsorgung:
Die Lösungen kommen zum Abwasser, die Feststoffe zum Hausmüll.
Literatur & Links:
B. Lutz, S. Schäfer: "Zeolithe: Kleine Poren - Große Wirkung"
Schriftenreihe des Chemischen Instituts Dr. Flad, Bd. 8;
Stuttgart: Verl. Dr. Flad, 1990
B. Lutz: "Zeolithe - ein Thema für die Schule?";
Naturwissenschaften im Unterricht - Chemie, 2 (1991), Nr. 10, 22-28
L. Puppe: "Zeolithe - Eigenschaften und technische Anwendungen";
Chemie in unserer Zeit, 20 (1986), 117-127
Dr. B. Lutz, Univ. Würzburg, persönliche Mitteilungen
Internet-Seiten zu Zeolithen (Auswahl):
Aufbau von Zeolithen, Anke Hagen, TU Dänemark
Vorlesung Silikatchemie von Caroline Röhr, Univ. Freiburg
weitere Links bei ChemLin
Fotos natürlicher Zeolithe von
Volker Betz,
M. und G. Spiess und
Karl Günter Wünsch
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Donnerstag, 31. Mai 2001, A. Schunk, CCC Univ. Erlangen.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!