

|
Experiment des Monats
|
Chromat-Ionen können in wässriger Lösung Dichromat-Ionen bilden. Das Gleichgewicht ist pH-abhängig und geht mit einer Farbänderung einher.
 |
Geräte und Chemikalien:
Kaliumchromat,
verd. Schwefelsäure,
verd. Natronlauge.
Becherglas, Reagenzgläser, Tropfpipetten.
Durchführung:
Eine Spatelspitze Kaliumchromat in Wasser lösen und die Lösung auf drei
Reagenzgläser verteilen. Eine Probe ansäuern, zu einer anderen Natronlauge geben.
Erklärung:
Zwei Chromat-Ionen bilden durch eine Kondensationsreaktion Dichromat:
2 CrO42– + 2 H+
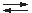 Cr2O72– + H2O
Cr2O72– + H2O
das Gleichgewicht wird gemäß Massenwirkungsgesetz durch den pH-Wert beeinflusst:
in saurer Lösung wird es in Richtung Dichromat verschoben, in alkalischer Lösung liegen
(mono)Chromate vor. Dichromat-Ionen sind orange, Chromat-Ionen gelb. Beim Alkalisieren beobachtet
man eine leichte Farbverschiebung nach gelb, beim Ansäuern wird die Lösung orange.
In stark saurer Lösung können sich größere Ionen bilden (Tri- und Tetrachromate
= Isopolysäuren), die noch intensiver gefärbt sind.
Gefahren:




Chromate sind giftig, vermutlich cancerogen, stark umweltschädigend und wirken brandfördernd,
Schwefelsäure und Natronlauge sind ätzend.
Entsorgung:
Die Lösungen werden zum Schwermetall-Abfall gegeben.
Literatur & Links:
F. Bukatsch, W. Glöckner: Experimentelle Schulchemie, Bd. 3, V. 275.
Holleman/Wiberg: "Lehrbuch der anorganischen Chemie", Kap. XXVII 1.2.1.
Jander/Blasius: "Lehrbuch der analytischen und präparativen anorganischen Chemie", Kap. 4.3.3.
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Samstag, 4. Januar 2014,
A. Schunk,
Charité - Universitätsmedizin Berlin.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!