
Experiment des Monats
November 1998
Mineralisches Chamäleon

|
Experiment des Monats |

Geräte und Chemikalien:
hohes 1l-Becherglas, kleine Bechergläser, Pipette.
(1) 1 g Kaliumpermanganat in 300 ml Wasser,
(2) 10 ml 50%ige Natronlauge
+ 10 ml 1%ige Natriumformiat-Lösung,
(3) halbkonzentrierte Schwefelsäure,
(4) 1%ige Natriumsulfit-Lösung.
Durchführung:
10 ml der Kaliumpermanganat-Lösung (1) in das Becherglas geben, mit Wasser
auffüllen und umrühren. Im Folgenden wird nicht mehr gerührt.
Lösung (2) eingießen, diese sinkt nach unten, wobei sich die violette
KMnO4-Lösung von unten nach oben blau färbt, gefolgt von
einer Grünfärbung. Nun 10 ml halbkonzentrierte Schwefelsäure
(3) mit einer Pipette unterschichten. Die grüne Farbe schlägt im
unteren Bereich nach braun um. Nach Unterschichten mit 5 ml Lösung (4)
entfärbt sich die braune Lösung teilweise. Alle Vorgänge brechen
ab, bevor die gesamte Lösung umschlägt, daher stehen am Ende fünf
verschiedenfarbige Zonen übereinander.
Erklärung:
Das violette Permanganation (MnVIIO4-) wird
nach und nach reduziert. Durch die alkalische Formiat-Lösung entsteht
vermutlich zunächst blaues Hypomanganat (MnVO43-),
das jedoch nicht stabil ist und durch noch vorhandenes Permanganat zum grünen
Manganat (MnVIO42-) oxidiert wird. (Eine
Disproportionierung des Hypomanganats ist unwahrscheinlich, da in diesem Fall
Braunstein (MnIVO2) ausfallen würde.) Die schmale
blaue Grenzschicht entsteht vermutlich als Mischfarbe von Manganaten in
verschiedenen Oxidationsstufen.
Beim Ansäuern erfolgt nun eine Disproportionierung des grünen
Manganats(VI) zu violettem Permanganat und gelbbraunem Manganit
(MnIVO44-). Man beobachtet als Mischfarbe
ein rotbraun.
Durch starke Reduktionsmittel, z.B. Sulfit (SO32-
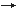 SO42-), kann Manganit(IV) zum
zweiwertigen Mangan-Kation (schwach rosa) reduziert werden.
SO42-), kann Manganit(IV) zum
zweiwertigen Mangan-Kation (schwach rosa) reduziert werden.
Gefahren:


Kaliumpermanganat und Natriumsulfit sind gesundheitsschädlich,
Schwefelsäure und Natronlauge ätzend.
Entsorgung:
Schwermetallabfall.
Literatur:
G. Wagner: "Chemie in faszinierenden
Experimenten" - Versuch 79, S. 95-99
G. Schwedt: "Goethe - neu coloriert" - Kultur & Technik,
4/1998, 51-54
 zurück zum aktuellen Experiment
zurück zum aktuellen ExperimentSeite erstellt am: Donnerstag, 29. Oktober 1998,
A. Schunk.