
Experiment des Monats
August 1999
Jodierung von Aceton

|
Experiment des Monats |
|
Bei Jodierungsreaktionen läßt sich der Endpunkt mittels der Jod-Stärke-Reaktion gut sichtbar nachweisen. Dies nutzen wir bei diesem Versuch, der an der Universität Ulm im Grundpraktikum Physikalische Chemie für Chemie-Lehramt durchgeführt wird, aus.
Aceton reagiert in salzsaurer wässriger Lösung mit Jod
unter Bildung von Jodaceton: 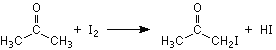 Es wird zunächst die Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration der Edukte untersucht. Daraus lassen sich die Reaktionsordnungen bezüglich der einzelnen Komponenten bestimmen. Danach wird diese Reaktion bei verschiedenen Temperaturen durchgeführt. Unter Anwendung der ARRHENIUS-Gleichung kann die Aktivierungsenergie berechnet werden. Herrn Prof. Dr. M. DAKKOURI, Abt. Elektrochemie, danke ich für die Unterstützung. |
 |
Geräte und Chemikalien:
Meßkolben (50 ml), Reagenzgläser, Meßpipetten,
Stoppuhr, temperierbares Wasserbad.
4-molare wässrige Aceton-Lösung
(29,4 ml Aceton mit Wasser auf 100 ml auffüllen),
1 M Salzsäure,
0,01 M Jodkaliumjodid-Lösung,
0,1%ige Stärke-Lösung
Die Reaktion mit folgenden Zusammensetzungen durchführen:Bei ca. 20oC Aceton-Lsg., Salzsäure, Stärke-Lsg. und Wasser in einem 50 ml Meßkolben zusammengeben und 10 Minuten thermostatisieren. Jodlösung zugeben und Uhr starten. Zur besseren Beobachtbarkeit die Lösung in ein Reagenzglas füllen. Reaktionszeit bis zur Entfärbung der blauen Jod-Stärke bestimmen.
4 M Aceton 1 M HCl 0,01 M KI I2
0,1% Stärke H2O (1) 5 ml 5 ml 5 ml 1 ml 9 ml (2) 10 ml 5 ml 5 ml 1 ml 4 ml (3) 5 ml 10 ml 5 ml 1 ml 4 ml (4) 5 ml 5 ml 10 ml 1 ml 4 ml
Auswertung:
Aus den Ergebnissen kann die Reaktionsordnung berechnet werden.
Für die Reaktionsgeschwindigkeit gilt:
(1) - d[I2]/dt =
k [Aceton]a [H3O+]b [I2]c
Da die Jodkonzentration sehr gering gewählt wurde, entspricht die bestimmte
Reaktionsgeschwindigkeit annähernd der Anfangsgeschwindigkeit:
(2) D[I2]/Dt
» (d[I2]/dt)t=0
(3) v = - D[I2]/Dt
»
k [Aceton]a [H3O+]b [I2]c
Wird die Konzentration z.B. von Aceton verdoppelt gilt:
(4) v' = - D[I2]'/Dt' =
k (2  [Aceton])a [H3O+]b [I2]c
[Aceton])a [H3O+]b [I2]c
D.h.: wenn die Reaktionsordnung a=1 ist, wird sich die Geschwindigkeit verdoppeln, bei a=2
vervierfachen usw..
Nun kann Gleichung (4) durch Gleichung (3) dividiert werden, man erhält:
(5) v'/v = 2a
Entsprechend können alle Reaktionsordnungen berechnet werden. Die
Gesamtordnung der Reaktion ergibt sich aus der Summe der Exponenten
(a+b+c).
Durch Einsetzen der Ordnungen und Konzentrationen läßt sich aus
Gl. (3) die Reaktionsgeschwindigkeitskonstante k berechnen.
Erklärung:
Bei dieser Reaktion findet eine
elektrophile
Substitution statt. Es erfolgt zunächst die Bildung des Enols
(Keto-Enol-Tautomerie des Acetons).
Diese Reaktion ist sehr langsam = der geschwindigkeitsbestimmende
Schritt. An das Enol kann nun sehr schnell Jod angelagert werden
(p-Komplex). Es bildet sich unter
I--Abspaltung der s-Komplex, der
sich durch Deprotonierung in Jodaceton umwandelt. Da Jod an der
langsamen Enolisierung nicht beteiligt ist, ist die Reaktionsordnung
bezüglich der Jod-Konzentration (c) annähernd 0, für die
Ordnungen bezüglich Aceton (a) und HCl (b) findet man Werte um 1.
 exp(EA/RT)
exp(EA/RT)
Hinweise:
Jodaceton wurde im 1. Weltkrieg als Kampfstoff eingesetzt und möglicherweise auch später noch.
Der Reinstoff und konzentrierte Lösungen wirken ätzend bzw. stark reizend und sind gesundheitsschädlich.
Inwieweit dies auf die stark verdünnten Lösungen in diesem Experiment übertragbar ist
(max. 1 mmol/l Jodaceton) ist umstritten.
Aus den genannten Gründen wird das Experiment teilweise für den Schulunterricht abgelehnt.
Gefahren:



Aceton ist leichtentzündlich, Salzsäure ätzend,
die Jodlösung wirkt reizend.
Entsorgung:
Die Lösungen werden als nichthalogenierte organische
Lösungsmittel-Abfälle entsorgt.
Literatur & Links:
A. Eucken, R. Suhrmann: "Physikalisch-Chemische
Praktikumsaufgaben" - S. 154-158
G. P. Matthews: "Experimental Physical Chemistry"
- S. 396-405
E. J. Slowinski: "Experimentelle Einführung ..."
- S. 131-139
Grundpraktikum Physikalische Chemie, V. 24: Jodierung von Aceton; Univ. Ulm, 1997/98
Für die Aktivierungs-Enthalpie liegt ein Literaturwert vor:
DHakt = 83,9 kJ/mol
Chiang, Kresge, Schepp: J. Am. Chem. Soc. 111 (1989), 3978
 zurück zum aktuellen Experiment
zurück zum aktuellen ExperimentSeite erstellt am: Donnerstag, 29. Juli 1999,
A. Schunk.