

|
Experiment des Monats
|
 |
In diesem Monat gibt es wieder einen Gastbeitrag von Thomas Seilnacht (http://www.experimente.net).
Aus Malachit kann mit einfachen Mitteln wieder Kupfer gewonnen werden.
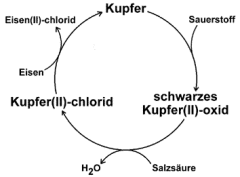 |
Eine zu einem Brief geformte Kupferfolie wird kräftig mit der nichtleuchtenden Brennerflamme erhitzt. Dabei bildet sich schwarzes Kupfer(II)-oxid, das mit verdünnter Salzsäure zu Kupfer(II)-chlorid umgewandelt werden kann. Man legt dazu die oxidierten Briefe einfach in eine Petrischale mit 10%iger Salzsäure. Legt man einen Eisennagel in die entstandene Lösung, scheidet sich in einem elektrochemischen Vorgang elementares Kupfer auf dem Nagel ab. Bei diesem einfachen Kreislauf entsteht beim Erhitzen des Kupfers mit dem Brenner zunächst schwarzes Kupfer(II)-oxid, das mit Salzsäure zu grünem Kupfer(II)-chlorid umgewandelt wird.
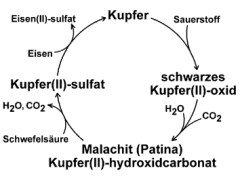 |
Komplizierter ist der erweiterte Kupferkreislauf, bei dem das Kupfer über zwei Zwischenschritte wieder erhältlich ist. Liegen die oxidierten Kupferbriefe lange in kohlendioxidhaltiger und feuchter Luft, bilden sich grünliche Schichten. Im Freien bildet die feuchte Luft zusammen mit dem Kohlenstoffdioxid auf der Oberfläche von oxidierten Kupferblechen allmählich einen grünlichen Überzug, der auch als Patina bezeichnet wird. Dieser Vorgang dauert in der Regel mehrere Jahre. Die Patina schützt das darunter liegende Kupfer vor weiterer Korrosion, daher ist Kupferblech für die Abdeckung von Türmen und Dächern gut geeignet. Der Überzug besteht im wesentlichen aus Malachit, einem Stoff der in der Natur als grünes Mineral vorkommt. Malachit war früher auch ein wichtiges Pigment.
 |
 |
Geräte und Chemikalien:
Kupferblech,
10%ige Salzsäure,
10%ige Schwefelsäure,
Malachit, pulverisiert
Brenner, Tiegelzange, Petrischalen, Spatel, unverzinkter Eisennagel
Durchführung:
Mit verdünnter Schwefelsäure kann der Malachit in Kupfer(II)-sulfat
umgewandelt werden. Dazu füllt man eine Petrischale zur Hälfte
mit 10%iger Schwefelsäure und gibt einen Spatel pulverisierten Malachit
hinzu. Unter Aufbrausen löst sich das Pulver auf, und es bildet sich
eine bläuliche Lösung. Legt man einen Eisennagel in diese Lösung,
kann das Abscheiden des Kupfers besonders schön beobachtet werden.
Auch andere hineingelegte Metalle überziehen sich mit einer Kupferschicht.
Gefahren:

Die verdünnten Säuren sind ätzend, daher sollte
eine Schutzbrille aufgezogen werden. Malachit (Kupfer(II)-hydroxidcarbonat)
ist gesundheitsschädlich.
Entsorgung:
Die Reste der Lösung kommen zum Schwermetall-Abfall.
Literatur & Links:
Dieser Versuch ist auf Thomas Seilnachts Chemieseite ausführlich
erläutert (mit vielen Materialien und hochauflösenden Fotos):
http://www.seilnacht.com/versuche/kreisr.html
© Thomas Seilnacht, 2004
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Sonntag, 31. Oktober 2004, A. Schunk, PU Marburg.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!