
|
Experiment des Monats
|
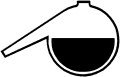
Die Homogene Katalyse wird hier anhand der Reduktion von Eisen(III) durch Thiosulfat demonstriert. In beiden Reagenzgläsern befindet sich Eisen(III)chlorid-Lösung. Der Lösung im rechten Reagenzglas wurde Kupfersulfat als Katalysator zugesetzt. Wird nun eine Thiosulfat-Lösung zugegeben (1), tritt zunächst eine rot-violette Färbung auf, die im rechten Reagenzglas sofort verschwindet. Im linken Glas hält die Färbung bis zu einer Minute an. (2)
 |
 |
Geräte und Chemikalien:
Reagenzgläser
0,05-molare Eisen(III)chlorid-Lösung,
5%ige Kupfersulfat-Lösung,
0,1-molare Natriumthiosulfat-Lösung.
Durchführung:
In zwei Reagenzgläser jeweils 20 ml 0,05-molare Eisen(III)chlorid-Lösung
füllen. Zur Lösung in einem Glas einige Tropfen verdünnter
Kupfersulfat-Lösung geben. Nun jeweils 20 ml 0,1-molare Thiosulfat-Lösung
zugeben. Es tritt in beiden Gläsern zunächst eine rotviolette Färbung
auf, die bei der kupferhaltigen Lösung sofort wieder verschwindet. Bei der
kupferfreien Lösung erfolgt die Entfärbung erst nach ½ - 1 Minute.
Erklärung:
Eisen(III)-salze bilden in wässriger Lösung mit Thiosulfat rot-violett
gefärbte Komplexe:
[Fe(H2O)6]3+ + S2O32– 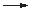 [Fe(H2O)4(S2O3)]+ + 2 H2O
[Fe(H2O)4(S2O3)]+ + 2 H2O
Der Thiosulfato-Eisenkomplex ist jedoch nicht beständig, er zerfällt gemäß:
2 [Fe(H2O)4(S2O3)]+ + 4 H2O 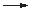 2 [Fe(H2O)6]2+ + S4O62–
2 [Fe(H2O)6]2+ + S4O62–
wobei Eisen(III) zu Eisen(II) reduziert wird. Der rot-violette Komplex zerfällt, die Lösung entfärbt sich. Einige andere Schwermetall-Ionen, beispielsweise Cu2+, katalysieren diese Redox-Reaktion.
Die gleiche Reaktion kann auch zur Demonstration der Temperaturabhängigkeit der Reaktionsgeschwindigkeit ausgenutzt werden. Das Reaktionsgemisch (ohne Katalysator!) wird bei verschiedenen Temperaturen angesetzt, man mißt die Reaktionszeit bis zur Entfärbung.
Gefahren:


Eisen(III)chlorid ist ätzend, Kupfersulfat und Natriumthiosulfat
sind gesundheitsschädlich.
Entsorgung:
Die Lösungen kommen zum anorganischen Schwermetall-Abfall.
Literatur & Links:
G. Jander / E. Blasius: "Lehrbuch der analytischen und präparativen
anorganischen Chemie" - S. 310
"Temperaturabhängigkeit der Geschwindigkeitskonstante",
Abt. Physikalische Chemie I, Univ. Siegen, Versuch 5.6.1.
"Chemisches Praktikum für Mediziner" -
CCC, Institut für Organische Chemie der Univ. Erlangen-Nürnberg:
Versuch 5.3
Dieser Versuch wird im Praktikum "Chemie für Mediziner" der Universität
Erlangen-Nürnberg durchgeführt.
Im Internet-Angebot zu diesem
Praktikum ist für diesen Versuch ein
Video abrufbar.
Frau Dipl.-Chem. Gisela Martinek danke ich sehr herzlich für die Unterstützung.
Juli 2000: Das Eiweiß im Eiklar
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Montag, 31. Juli 2000, A. Schunk.