

|
Experiment des Monats
|
Die Reaktionsgeschwindigkeit hängt insbesondere von den Konzentrationen der beteiligten Stoffe und der Temperatur ab. Dieses einfache Experiment ist gut geeignet, diese Abhängigkeiten zu zeigen. Der Verlauf der Fällungsreaktion läßt sich auf einem kontrastreichen Untergrund (z.B. einem schwarzen Kreuz auf weißem Papier) leicht verfolgen.
 |
 |
 |
Geräte und Chemikalien:
Erlenmeyerkolben 100 ml, 3 Meßzylinder, Wasserbad mit Heizplatte, Eis,
Thermometer, Stoppuhr, weißes Blatt mit schwarzem Kreuz
0,2-molare Natriumthiosulfat-Lösung,
2-molare Salzsäure.
Durchführung:
Zuerst wird die Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit
untersucht. Dazu werden unterschiedliche Mengen Thiosulfat mit der gleichen Menge
Salzsäure umgesetzt:
(1) 50 ml Na2S2O3-Lösung
+ 0 ml Wasser + 5 ml Salzsäure
(2) 40 ml Na2S2O3-Lösung
+ 10 ml Wasser + 5 ml Salzsäure
(3) 30 ml Na2S2O3-Lösung
+ 20 ml Wasser + 5 ml Salzsäure
(4) 20 ml Na2S2O3-Lösung
+ 30 ml Wasser + 5 ml Salzsäure
(5) 10 ml Na2S2O3-Lösung
+ 40 ml Wasser + 5 ml Salzsäure
Die Lösungen jeweils in einem Erlenmeyerkolben zusammengeben, gut schütteln
und gleichzeitig die Uhr starten.
Den Kolben auf das scharze Kreuz stellen und die Zeit messen, bis das Kreuz
nicht mehr erkennbar ist. Es ist darauf zu achten, daß alle Versuche bei der
gleichen Temperatur (Raumtemperatur, ca. 20°C) durchgeführt werden.
In einem zweiten Schritt wird die Temperaturabhängigkeit untersucht,
beispielsweise bei 10°C, 20°C, 30°C und 40°C. Dazu wird die
Zusammensetzung (4) verwendet. 20 ml Thiosulfat-Lösung und 30 ml
Wasser im Kolben zusammengeben und im Wasserbad auf 30°C bzw. 40°C
erwärmen. Dann 5 ml Säure zugeben und die Uhr starten. Erst jetzt
wird die genaue Temperatur gemessen. Wiederum warten, bis das schwarze Kreuz nicht
mehr sichtbar ist. Für die Durchführung bei 10°C wird der Ansatz in
Eiswasser gekühlt.
Erklärung:
Durch Protonierung der Thiosulfat-Ionen entsteht Thioschwefelsäure.
Diese ist nicht stabil und zerfällt in schweflige Säure (bzw. Schwefeldioxid
+ Wasser) und elementaren Schwefel (als S8). Der Schwefel-Niederschlag
führt zu einer Trübung der Lösung
(vgl. EdM 09/1999)
S2O32– + 2 H+
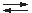 H2S2O3
H2S2O3
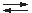 SO2 + H2O + S ¯
SO2 + H2O + S ¯
Das sehr einfach gestaltete Experiment lässt zunächst nur qualitative
Aussagen zur Reaktionskinetik zu. Es zeigt, daß bei abnehmender Konzentration
die Reaktionszeit immer länger wird, die Reaktionsgeschwindigkeit also abnimmt.
Die Temperaturabhängigkeit bestätigt die "RGT-Regel": bei einer
Erhöhung der Temperatur (T) um 10 K verdoppelt sich in etwa die
Reaktionsgeschwindigkeit (RG).
Gefahren:
Salzsäure ist ätzend.
Entsorgung:
Die neutralisierten Lösungen können zum Abwasser gegeben werden.
Literatur & Links:
M. Jäckel, K. T. Risch (Hrsg.): "Chemie heute".
Hannover: Schroedel, 1988
E. Habekost, A. Habekost: "Einführung in die Reaktionskinetik".
PdN-Ch 44 (1995), 9-13
Jens Salzner: persönliche Mitteilung
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Mittwoch, 30. April 2008,
A. Schunk,
Charité - Universitätsmedizin Berlin.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!